- 易迪拓培训,专注于微波、射频、天线设计工程师的培养
镁燃料电池的研究进展
1 引言
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运、可使用温度范围宽(–20℃~80℃)及污染小等特点[1]。作为一种高能化学电源,拥有良好的应用前景,因此很多研究学者与单位对其进行了研究。早在20世纪60年代,美国GE公司就对中性盐镁燃料电池进行了研究[2]。随后美国海军海底战事中心(Naval Undersea Warfare Center)与麻省理工大学(University of Massa-chusetts Dartmouth)以及BAE Systems公司共同研制成功了用于自主式潜航器的镁-过氧化氢燃料电池系统[3]。该电池采用海水作电解质,镁合金作阳极材料,液态过氧化氢作阴极氧化剂。该电池提供了一个成本较低并且更为安全的高能动力,是低速率、长寿命的自主式潜航器的理想驱动电源。20世纪90年代初,Westinghouse公司研制出了海洋应用的圆柱型海水电解质镁/空气燃料电池[4]。1996年,挪威与意大利共同开发了镁燃料电池,并应用于180m深的海底油井或气井探测的海洋水下自动控制系统。该海水电池采用商业镁合金作阳极,海水作电解质,海水中溶解的氧为氧化剂,阴极用碳纤维制造。这个电池系统能量达到650kWh,系统设计寿命为15年[5]。加拿大Greenvolt Power公司研制的100W和300W级镁/盐水/空气燃料电池(MASWFC),能量密度是铅酸电池的20倍以上,可为电视、照明灯、便携电脑、手机及GPS等设备供电。加拿大Magpower Systems公司研制的盐水电解质镁/空气燃料电池,能连续提供300W功率,成功应用于偏远地区水净化系统水泵的供电[6]。Medeiros等研究了Mg-H2O2半燃料电池,电池的阳极为镁合金AZ61,导离子膜是Nafion-115,阴极为垂自植入到碳纸上的碳纤维担载的Pd-Ir,阳极电解液为海水,阴极电解液为海水 硫酸 过氧化氢,单电池在连续30 h的放电期间内,在25mA/cm2的电流密度下,电池电压稳定在1.77V~1.8 V之间。根据消耗的镁,过氧化氢和硫酸的质量计算出来电池的比能量达500~520Wh/kg[7]。
然而,镁燃料电池总体上存在着三大缺陷[1, 6, 8]:(1)容量损失大,(2)负极利用率低,(3)电压损耗大。其中,容量损失大和负极利用率低主要是由于镁的自腐蚀引起的,而镁的负差效应将进一步加剧镁的自腐蚀,因此,很多学者通过制备镁合金和运用电解液添加剂两种途径来降低镁的自腐蚀,提高电池容量和负极利用率。而电压损耗大则受镁及镁合金放电产物和正极活性物质的影响,可通过运用电解液添加剂和制备新型催化剂来解决。
本文将镁燃料电池的研究进展分为工作原理、电极的研究和电解液添加剂三部分进行阐述。
2 镁燃料电池的工作原理
镁燃料电池(Magnesium fuel cell,又称Magnesium semi-fuel cell)主要由镁合金阳极,中性盐电解质和空气(氧气或其它氧化剂)阴极三部分组成。镁及镁合金是非常活泼的金属,适合用作阳极材料。阴极氧化剂可以利用空气或者海水中的氧,还有过氧化氢和次氯酸盐等,根据氧化剂不同,目前研究的燃料电池可分为镁-空气燃料电池,镁-海水燃料电池,镁-过氧化氢燃料电池,镁-次氯酸盐燃料电池[1, 6, 8, 9]。
2.1 镁-空气燃料电池
镁-空气燃料电池工作原理示意图如1所示。
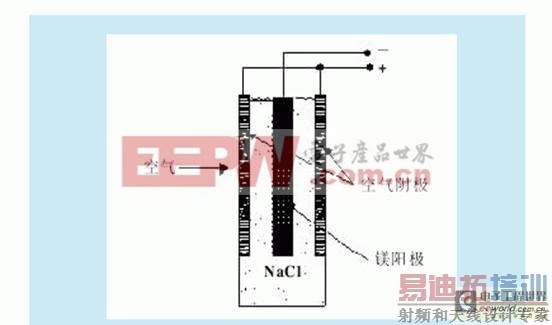
图1 镁-空气燃料电池工作示意图。
中性盐条件下镁-空气燃料电池的放电反应机理如下:
阳极反应:Mg→Mg2 2e- –2.37 V
阴极反应:O2 2H2O 4e-→4OH- 0.40 V
电池总反应:Mg 1/2O2 H2O→Mg(OH)2 2.77 V
中性盐电解质镁-空气燃料电池的寄生反应:
析氢反应:Mg 2H2O→Mg(OH)2 H2↑
2.2 镁-海水燃料电池
镁-海水燃料电池结构示意图如2所示。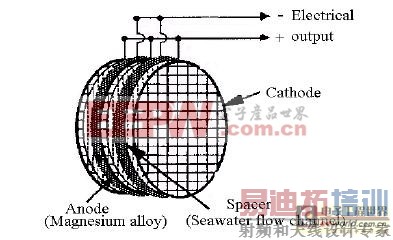

图2镁-海水燃料电池结构示意图
镁-海水溶解氧半燃料电池的放电反应机理类似于镁-空气电池。
2.3 镁-过氧化氢燃料电池
镁-过氧化氢燃料电池是镁-空气(氧)燃料电池的一个分支,其工作原理示意图如图3所示。
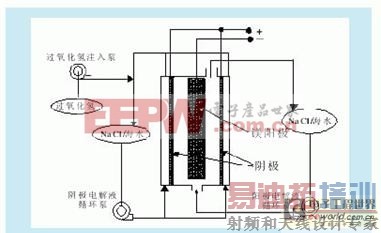
图3 镁-过氧化氢燃料电池工作示意图
中性盐电解质镁-过氧化氢燃料电池的放电反应:
阳极反应:Mg→Mg2 2e- -2.37 V
阴极反应:HO2- H2O 2e-→3OH- 0.88 V
电池总反应:Mg HO2- H2O→Mg2 3OH- 3.25 V
中性盐电解质镁-过氧化氢燃料电池的寄生反应:
分解反应:2H2O2→2H2O O2↑
沉淀反应:Mg2 2OH-→Mg(OH)2(s)
Mg2 CO32-→MgCO3(s)
析氢反应:Mg 2H2O→Mg(OH)2 H2↑
酸性条件下镁-过氧化氢燃料电池的放电反应机理如下:
阳极反应:Mg→Mg2 2e- -2.37 V
阴极反应:H2O2 2H 2e-→2H2O 1.77 V
电池反应:Mg H2O2 2H →Mg2 2H2O 4.14 V
2.4 镁-次氯酸盐燃料电池
镁-次氯酸盐燃料电池工作原理示意图如4所示。
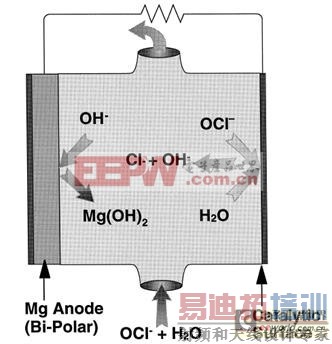
图4 镁-次氯酸盐燃料电池工作原理示意图
中性盐电解质镁-次氯酸盐燃料电池的放电反应:
阳极反应:Mg→Mg2 2e- -2.37 V
阴极反应:ClO- H2O 2e-→Cl- 2OH- 0.90 V
电池总反应:Mg ClO- H2O→Cl- 2OH- 3.27 V
中性盐电解质镁-次氯酸盐燃料电池的寄生反应:
分解反应:2ClO-→Cl- ClO2
沉淀反应:Mg2 2OH-→Mg(OH)2(s)
Mg2 CO32-→MgCO3(s)
析氢反应:Mg 2H2O→Mg(OH)2 H2↑
3 电极的研究
3.1正极
镁燃料电池正极是空气中的O2等氧化剂,其参加反应需要一定的催化剂,这些催化剂能够加速氧化剂在溶液中的电还原反应速率,因此催化剂的催化性能是影响电池性能的重要因素之一,特别是针对氧化剂在中性溶液中的催化。下面就空气中的O2、海水中的O2和H2O2的催化剂进行阐述。
3.1.1 空气中O2的催化剂
目前,空气阴极采用的催化剂主要有贵金属催化剂(铂、铂合金和银)、钙钛矿型氧化物催化剂、金属有机鳌合物催化剂、MnO2催化剂等。贵金属铂基催化剂用作空气阴极氧还原电催化剂显示出良好的催化活性,但由于铂价格昂贵,限制了它的市场化与应用范围。近年来有关金属燃料电池用非铂催化剂阴极研究报道较多,并取得了较大的进展。Gamburzev等[10]人开发了不同碳载体的银电催化剂制备方法,并且对银催化剂空气扩散电极在碱性电解质中的电催化性能进行了研究,结果表明,碳载体银催化剂电极的性能比只有碳催化剂时提高3倍。Wagner等[11, 12]采用PTFE作有机粘结剂,与银粉或氧化银粉催化剂相混合,通过冷压处理过程,得到高比表面积的多孔气体扩散电极。PTFE纤维在电极中呈蜘蛛网结构,形成了很好的疏水孔系统,有利于气体的传输,提高了催化剂的催化活性与稳定性,电流密度达到650mA/cm2,使用寿命长达5000h。
钙钛矿型催化剂也是较好的电催化剂,Li[13]等采用改进的无定型柠檬酸前驱体法合成了LiMn2–xCoxO4系列尖晶石型氧化物,与传统制备方法相比,催化剂比表面积明显增加。金属大环化合物,特别是金属(Fe、Co)赘合物如酞菁、卟琳也都被认为对氧还原有电催化活性,Bron等[14]对碳载叶琳铁化合物进行热处理,制得氧还原电催化剂,其活性虽然低于含10%Pt的商业Pt/C催化剂的活性,但就催化剂中的金属含量而言,两者活性相当。
MnO2催化剂作为氧还原电催化剂,具有价格低廉的优势,具有广阔的应用前景。Z. D. Wei等[15, 16]研究了碳载MnO2催化剂的空气电极,把碳黑和硝酸锰溶液混合后在不同温度下加热焙烧,发现在340℃时制得的MnO2催化剂活性最好,同时进一步研究了Mn3O4对于形成有利于氧还原的MnO2晶体的引导作用。T. Ohsaka、Y. L. Cao等[17-19]对MnO2催化剂的氧还原机理进行了研究。目前,纳米结构的MnO2催化剂是一个研究热点。J. S. Yang等[20]研究了纳米无定型MnO2电催化剂的氧还原性能,在0.85mg/cm2的低催化剂载量的情况下,氧还原反应电流密度可达到100mA/cm2以上。G. Zhang等[21]合成了纳米结构的中间相碳微粒MnO2复合催化剂,由于该催化剂的纳米尺寸网状结构与高密度活性点的优点,制备的空气电极氧还原反应催化活性明显增强。
3.1.2 海水中O2的催化剂
海水中溶解的氧气作为氧化剂时,由于氧气浓度低,要求阴极要具有良好的传质性能、大的表面积和高的催化性能,同时由于电池寿命长,电极必须具有良好稳定性。目前的研究发现,碳纤维是较好的阴极材料。Hasvold等[22]将碳纤维做成瓶刷状,使其具有大的表面积和良好的传质性,以其为阴极制备的镁-海水溶解氧半燃料电池,在2W的输出功率下,初始电压可达1.4 V,运转15h后电压增加并稳定在1.6V;电压的增加可能是由于在碳纤维表面生长了海洋生物膜,提高了其催化活性。Shen等[23]人研究了用Co3O4/C作为铝-海水溶解氧气电池的阴极材料,进行了为期70d的测试,其结果表明与用Pt/C作催化剂的电池性能相当,并且电压稳定。
3.1.3 H2O2的催化剂
H2O2在阴极的反应包括直接和间接两种反应途径。直接途径是H2O2通过电化学还原反应直接生成H2O或OH–;间接途径是H2O2先分解出O2,O2进一步电还原为H2O或OH–。在实际的半燃料电池中,这两种途径并存。直接途径更为有利,因为间接途径O2生成速率如大于O2消耗速率,将导致O2过剩和积累,系统内压升高,需设置排气系统,造成电池结构复杂及安全性降低。因此对H2O2阴极的要求是:(1)催化活性高,提高反应速率,减少活化过电势;(2)直接电还原选择性高,减少O2生成;(3)传质性能好,减少浓度极化。
日前针对H2O2的催化剂主要有两类,一类是负载在碳基材料(如碳纸、碳布和碳纤维)或泡沫镍上的Pd、Ir、Ag和Au等贵金属及其合金制备的电极[24-26]。这类催化电极具有较好的活性和稳定性,但均催化H2O2的分解反应;另一类是Fe和Co的卟琳以及Cu的三嗪类大分子络合物为前驱体制备的炭负载非贵金属催化剂。这类催化剂的主要问题是稳定性差。
3.2 负极
镁燃料电池的负极是镁及镁合金,但作为电池负极材料存在以下问题。镁及镁合金在水溶液中析氢量大,即自腐蚀速度快,导致容量损失大和负极利用率低;此外,镁及镁合金在放电过程中还存在负差效应,使得自腐蚀速率进一步增大,从而影响镁燃料电池的放电性能。
目前,解决镁及镁合金作为电池负极材料所存在问题的途径主要是开发新的合金,制备纳米或者微米结构的镁及镁合金和对镁及镁合金进行表面处理。
开发新合金,即将镁和其它合金元素制成二元、三元乃至多元合金。一方面可以细化镁合金晶粒,增大析氢反应的过电位,以降低自腐蚀速度;一方面可以破坏钝化膜的结构,使得较为完整、致密的钝化膜变成疏松多孔、易脱落的腐蚀产物,从而促进电极活性溶解,提高镁合金的电化学性能。目前,国内外研究学者对新合金的开发进行了广泛研究。镁与铝和锌形成的合金的性能较好,日前用于水下电源的镁半燃料电池中使用的镁合金有AZ31和AZ61[7, 27],英国Magnesium Elektron公司开发出了AP65和MT75镁合金[28],其特点是电位高、析氢量低、成泥少,析氢速度为0.15mL min–1 cm–2,阳极利用率为84.6%,开路电位为–1.803 V ( vs. SCE)。王宇轩等[29]制备了Mg-Ga-X合金,此三元合金具有阳极极化小,析氢量低,腐蚀产物易脱落,成泥少的特点。邓妹皓[30]等则研究了四种添加元素(Pb、Sn、Ga、稀土)对镁合金的电化学性能的影响。马正青[31]等在Mg中添加了Hg,并对合金性能进行了研究。Y. Feng等[32-34]则在Mg中添加了Hg和Ga,认为Hg和Ga的加入能够提高镁合金的电化学性能,作为负极材料能够提高电池的开路电压。
此外,在镁中添加锂形成镁锂合金是有意义的事情,相对比其他镁合金,从电动势的角度来讲,添加比镁更为活泼的锂,能够使镁锂合金有更高的理论电压和理论容量。目前,已经有研究人员对镁锂合金进行了研究。D. X. Cao等[35, 36]研究了不同镁锂合金作为水下镁燃料电池负极材料的可行性,针对Mg-Li二元合金以及添加Al、Ce、Zn和Mn等元素形成多元合金均进行了研究,结果表明,跟传统的Mg和AZ31相比,Mg-Li合金拥有较高的利用率和较高的电化学活性。印度学者A.sivashanmugam[37]研究了Mg-13Li合金在不同溶液的腐蚀速率和电化学行为,并研究了Mg–Li/MgCl2/CuO一次电池的性能,结果表明,跟传统的Mg和Mg-Al合金相比,Mg–13Li合金能够提供更高的容量和利用率。虽然镁锂合金作为负极材料的研究不多,但镁锂合金有作为镁燃料电池的可行性。
随着纳米技术的发展,将镁及镁合金制备成纳米/微米结构,利用材料尺寸减小后改变的物理和化学性能,能够提高镁燃料电池的性能[38],W. Y. Li等[39]制备了纳米/微米结构的镁,应用于镁-空气电池,在5mA/cm2电流密度下,获得了565Wh/Kg的能量密度。M. H. Grosjean等[40]利用球磨法制备了微米结构的镁,并研究了其电化学行为,M. Zidoune等[41]利用电化学交流阻抗法研究了球磨前后的电化学行为,Yamamoto等[42]利用球磨技术将镁及镁合金制备成为微米结构,并在其专利上提出了应用于镁-空气电池的可行性。总之,如果能够解决在研磨过程中镁及镁合金氧化的问题,以及大规模制备纳米/微米结构镁合金的技术难题,相信镁合金能够代替锌粉,成为合格的负极材料。
表面处理方面,刘钧泉[43]用不同的化学镀工艺对AZ91D镁合金片进行表面处理,测定了两种工艺及不同处理时间的放电特性。试验表明,短时间化学镀镍表面的镁合金放电电流大于镀铜表面和空白试样。
3.3 电解液及添加剂
目前,镁燃料电池电解液主要采用钠盐和镁盐等简单的中性溶液,相对于碱液,虽然O2等氧化剂在中性溶液中反应速率较慢,从而降低了镁燃料电池的运行电压,但中性溶液也有优势,例如在金属空气领域,中性溶液能够避免碱液在长时间运行下的碳酸盐化问题,而且中性溶液比碱液更加安全。
此外,随着对电池负极材料利用率和寿命的要求,需要通过在溶液中添加一些溶剂以改善镁合金作为电池负极材料的性能。添加剂的作用有两方面,一方面需要在电解液中添加氢抑制剂,以降低过电势和自腐蚀性,减小自腐蚀速度、提高镁合金阳极利用率,另一方面添加破坏镁的腐蚀产物膜结构的活化剂,促进腐蚀产物的脱落、活化镁负极、提高电池的寿命。例如,D. X. Cao等[35]在NaCl溶液中添加了Ga2O3,能够使镁锂合金利用率提高5%。然而,目前针对镁燃料电池的添加剂和其作用机理研究报道极少,可以借鉴锌燃料电池和铝燃料电池电解液的添加剂的研究。
4 应用前景
镁燃料电池作为一种环境友好的高性能电源,特别是中性盐或海水电解质镁燃料电池系统,有着优良的性能价格比。可以通过开发各种新型的镁合金阳极、阴极电催化剂和电解质添加剂以及优化阴极结构,使镁燃料电池的研究能够获得突破性的进展。镁燃料电池在可移动电子设备电源、自主式潜航器电源、海洋水下仪器电源和备用电源等方面,具有非常广阔的应用前景。
射频工程师养成培训教程套装,助您快速成为一名优秀射频工程师...
天线设计工程师培训课程套装,资深专家授课,让天线设计不再难...
上一篇:5V到3.3V的几种电源方案
下一篇:TI案例:以较少电容达到更快速的瞬时响应

